Make this article seo compatible,Let there be subheadings for the article, be in french, create at least 700 words
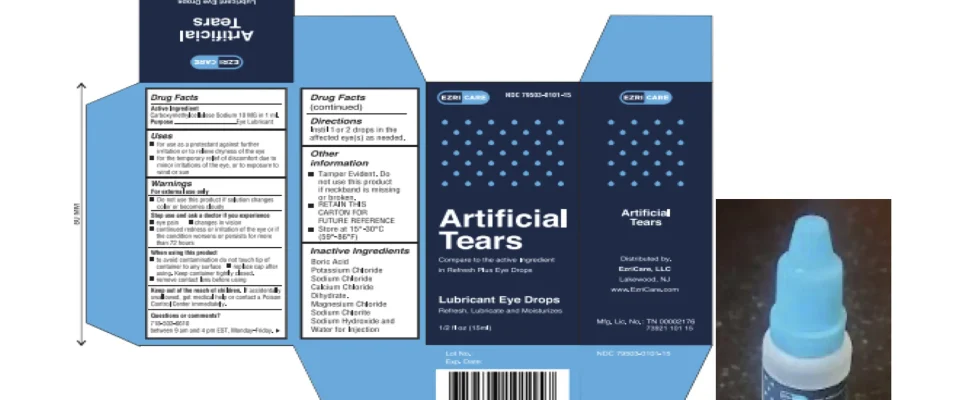
WASHINGTON (AP) – Le fabricant de collyres récemment lié à des décès et des blessures manquait de mesures pour assurer la stérilité dans son usine en Inde, selon les inspecteurs sanitaires américains.
Les responsables de la Food and Drug Administration ont découvert une douzaine de problèmes avec la façon dont Global Pharma Healthcare fabriquait et testait ses gouttes ophtalmiques lors d’une inspection de fin février à début mars. La FDA a publié lundi son rapport d’inspection préliminaire.
La société utilise des procédures qui ne peuvent pas réellement garantir que ses produits sont stériles, a écrit le personnel de la FDA. En particulier, les inspecteurs ont constaté que l’usine avait utilisé « un processus de fabrication déficient » entre décembre 2020 et avril 2022 pour des produits qui ont ensuite été expédiés aux États-Unis.
L’usine de l’État du Tamil Nadu, dans le sud de l’Inde, a produit des gouttes pour les yeux qui ont été liées à 68 infections bactériennes aux États-Unis, dont trois décès et huit cas de perte de vision. Quatre personnes ont subi une ablation chirurgicale des globes oculaires en raison d’une infection. Les gouttes ont été rappelées en février par deux distributeurs américains, EzriCare et Delsam Phama.
Le foyer est considéré comme particulièrement inquiétant car la bactérie qui l’anime est résistante aux antibiotiques standards.
Les inspecteurs sont arrivés à l’usine le 20 février, plus de deux semaines après l’annonce du premier rappel de collyre le 3 février. L’inspection semble être la première visite de la FDA à l’usine, selon les archives de l’agence.
Le rapport contient les conclusions préliminaires de l’agence et sera probablement suivi d’un rapport officiel et d’une lettre d’avertissement à l’entreprise. Un porte-parole de la FDA a déclaré que l’inspection indiquait que les produits de la société « pourraient être en violation des exigences de la FDA ».
« Nous exhortons les consommateurs à cesser d’utiliser ces produits qui peuvent être nocifs pour leur santé », a écrit Jeremy Khan de la FDA dans un communiqué envoyé par courrier électronique.
La FDA est chargée d’assurer la sécurité des produits étrangers expédiés aux États-Unis, bien qu’elle ait longtemps lutté pour suivre le rythme des chaînes d’approvisionnement pharmaceutiques internationales qui commencent de plus en plus en Inde et en Chine.
Les inspecteurs de la FDA ont cité des conditions sanitaires inquiétantes à l’usine de Global Pharma, notant que ses sols, murs et plafonds n’étaient pas « facilement nettoyables ». À un moment de la visite, un inspecteur de la FDA a noté qu' »aucun des équipements de la machine de remplissage n’était emballé ou couvert ». L’inspecteur a également noté que l’entreprise n’avait pas de procédures rigoureuses pour s’assurer que les bouteilles étaient entièrement scellées. Au lieu de cela, une « inspection visuelle manuelle est le seul test pour détecter toute fuite », selon le rapport.
Global Pharma a peu parlé publiquement de ses récents rappels, renvoyant plutôt des questions aux entreprises américaines qui vendaient les produits.
La FDA a enquêté sur les infections bactériennes américaines aux côtés des Centers for Disease Control and Prevention. Les responsables du CDC ont détecté la souche bactérienne dans des flacons ouverts de gouttes EzriCare collectées auprès de patients infectés. Les responsables de la FDA testent également des flacons non ouverts de gouttes.
Les responsables du CDC craignent que la bactérie ne se propage et des cas pourraient être signalés pendant des semaines et des mois à venir. L’agence a exhorté les établissements de santé traitant des patients à suivre des recommandations strictes de contrôle des infections, car le germe peut se propager rapidement.
___
Le département de la santé et des sciences de l’Associated Press reçoit le soutien du groupe des médias scientifiques et éducatifs de l’Institut médical Howard Hughes. L’AP est seul responsable de tout le contenu.