Make this article seo compatible,Let there be subheadings for the article, be in french, create at least 700 words
Neuf nouveaux médicaments recommandés pour approbation
Le comité des médicaments à usage humain (CHMP) de l’EMA a recommandé l’approbation de neuf médicaments lors de sa réunion de mars 2023.
Le CHMP a recommandé d’autoriser le vaccin COVID-19 Bimervax (anciennement COVID-19 Vaccine HIPRA) comme rappel chez les personnes âgées de 16 ans et plus qui ont déjà été vaccinées avec un vaccin à ARNm COVID-19. Il s’agit du huitième vaccin recommandé dans l’Union européenne (UE) pour se protéger contre le COVID-19 et, avec les vaccins déjà autorisés, il soutiendra les campagnes de vaccination dans les États membres de l’UE pendant la pandémie. Un aperçu de tous les vaccins COVID-19 autorisés dans l’UE est disponible sur le site web de l’EMA. Voir plus d’informations dans l’annonce de nouvelles dans la grille ci-dessous.
Le comité a adopté un avis favorable pour Briumvi (ublituximab) pour le traitement de la sclérose en plaques récurrente, une maladie du cerveau et de la moelle épinière dans laquelle l’inflammation détruit l’enveloppe protectrice entourant les nerfs et les nerfs eux-mêmes.
Omvo (mirikizumab) a reçu un avis favorable du CHMP pour le traitement de la rectocolite hémorragique active modérée à sévère, une inflammation du gros intestin provoquant des ulcérations et des saignements.
La commission a recommandé l’octroi d’une autorisation de mise sur le marché à usage pédiatrique (PUMA) pour Pedmarqsi (thiosulfate de sodium) pour la prévention de l’ototoxicité induite par la chimiothérapie au cisplatine. L’ototoxicité est le développement de problèmes d’audition ou d’équilibre dus à un médicament et le cisplatine est une chimiothérapie utilisée pour traiter plusieurs types de cancer. Pedmarqsi est indiqué chez les patients âgés d’un mois à 18 ans atteints de tumeurs solides localisées non métastatiques.
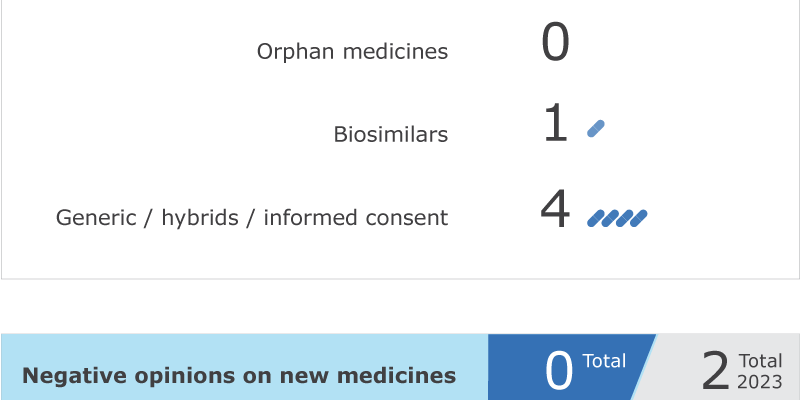
Le comité a adopté un avis favorable pour Epysqli (eculizumab), un médicament biosimilaire pour le traitement de l’hémoglobinurie paroxystique nocturne, une maladie rare qui entraîne la destruction prématurée et une altération de la production de cellules sanguines.
Le CHMP a rendu un avis favorable à Qaialdo (spironolactone) pour la prise en charge de l’œdème réfractaire, un gonflement persistant qui ne répond pas à l’utilisation de diurétiques et à la restriction sodée. Ce médicament a été déposé sous la forme d’une demande hybride, qui s’appuie en partie sur les résultats des tests précliniques et des essais cliniques d’un produit de référence déjà autorisé et en partie sur de nouvelles données.
Le comité a adopté des avis positifs pour trois médicaments génériques :
- Dabigatran Etexilate Accord (dabigatran etexilate) pour la prévention des événements thromboemboliques veineux ;
- Lacosamide Adroiq (lacosamide) pour le traitement de l’épilepsie ;
- Sugammadex Adroiq (sugammadex) pour l’inversion du blocage neuromusculaire induit par le rocuronium ou le vécuronium.
Recommandations sur les extensions d’indication thérapeutique pour six médicaments
Le comité a recommandé six extensions d’indication pour des médicaments déjà autorisés dans l’UE : Breyanzi, Entresto et son duplicata Néparvis, Tenkasi, Ultomiris et Wegovy.
Pour Ultomiris, le comité a également recommandé une nouvelle voie d’administration avec un nouveau dosage et une nouvelle forme pharmaceutique.
Retraits de candidatures
Trois demandes d’AMM ont été retirées :
- Ferahemedestiné pour le traitement intraveineux de l’anémie ferriprive.
- Ontéodestiné pour le traitement de la polyarthrite rhumatoïde, de l’arthrite juvénile idiopathique systémique active, de la polyarthrite juvénile idiopathique, de l’artérite à cellules géantes, du traitement de la polyarthrite rhumatoïde, de l’arthrite juvénile idiopathique systémique active, de la polyarthrite juvénile idiopathique et de la COVID-19.
- Raltégravir Viatrisdestiné au traitement de l’infection par le virus de l’immunodéficience humaine (VIH-1).
Des documents questions-réponses sur les retraits de Feraheme et de Raltegravir Viatris sont disponibles dans la grille ci-dessous. Onteeo est un duplicata d’un médicament actuellement en cours d’évaluation.
Ordre du jour et procès-verbal
L’ordre du jour de la réunion du CHMP de mars 2023 est publié sur le site internet de l’EMA. Le procès-verbal de la réunion du CHMP de février 2023 sera publié dans les prochaines semaines.
Statistiques du CHMP
Les chiffres clés de la réunion du CHMP de mars 2023 sont représentés dans le graphique ci-dessous.